Рубрика: Новости мира
-

В Гуанси прошла конференция по вопросам технологичного развития спортивной индустрии
19 декабря 2020 года в городе Фанчэнгане Гуанси-Чжуанского автономного района прошла конференция Китай-АСЕАН по вопросам высококачественного развития массовых развлекательных мероприятий в сфере спортивного туризма (China-ASEAN Sports Tourism Carnival High-quality Development Conference) с тематическим названием «Создание благоприятных условий для качественного роста спортивной индустрии и стимулирование новой модели развития». Вслед за такими мероприятиями, как «Winter Tourin Guangxi»…
-

В Гуанси прошла конференция по вопросам технологичного развития спортивной индустрии
19 декабря 2020 года в городе Фанчэнгане Гуанси-Чжуанского автономного района прошла конференция Китай-АСЕАН по вопросам высококачественного развития массовых развлекательных мероприятий в сфере спортивного туризма (China-ASEAN Sports Tourism Carnival High-quality Development Conference) с тематическим названием «Создание благоприятных условий для качественного роста спортивной индустрии и стимулирование новой модели развития». Вслед за такими мероприятиями, как «Winter Tourin Guangxi»…
-

Dreame Technology представил интеллектуальный завод по производству двигателей для пылесосов
Один из ведущих разработчиков технологий «умный дом» бренд Dreame Technology (Dreame) впервые представил свой интеллектуальный завод по производству двигателей с мощностями для массового производства высокоскоростных двигателей со скоростью до 150 000 оборотов в минуту, которые будут установлены на новую модель беспроводных пылесосов, выпуск которой ожидается в марте 2021 года. В 2020 году компания Dreame успешно разработала…
-

Разрешение FOPH на реализацию теста на антитела к вирусу SARS-CoV-2 получено LumiraDx
Компания LumiraDx, специализирующаяся на разработке средств диагностики в полевых условиях, объявила о получении разрешения Федерального управления здравоохранения Швейцарии (FOPH) на реализацию теста LumiraDx на антитела к вирусу SARS-CoV-2 после получения положительного результата технический проверки, проведенной Швейцарским обществом микробиологии (Swiss Society for Microbiology, SSM). По результатам теста было достигнуто 98,4-100% совпадение положительных результатов и 99% совпадение отрицательных результатов по сравнению…
-

В Хэнани дан старт китайскому фестивалю фотографии China Photography Festival
20 декабря в г. Саньмэнься (Хэнань, Китай) открылся 13-й китайский фестиваль фотографии China Photography Festival, а также 4-я международная выставка фотографий China Sanmenxia Natural Ecology. В рамках фестиваля будет организована серия выставок, среди них — выставка фотографий на тему борьбы с нищетой и тематическая выставка о борьбе с пандемией COVID-19. Богатая визуальная коллекция состоит из 4 000…
-

Тест-система Allplex™ от Seegene поможет ускорить борьбу с пандемией в Европе
В четверг южнокорейская биотехнологическая компания SeegeneInc. (KQ096530), специализирующаяся на разработке средств молекулярной диагностики, заявила о том, что в Европе уже предлагается безэкстракционная система Allplex™ для тестирования на вирусы SARS-CoV-2/грипп типа A/грипп типа B/РСВ. Ранее в сентябре компания Seegene получила для этого продукта маркировку CE-IVD, а в октябре уже приступила к его реализации Европе. Разработанная компанией…
-

Система MaxSpan EastWest™ от GameChange – достойный вариант для будущих владельцев
Компания GameChange Solar объявила о том, что ее клиенты по всему миру проявляют повышенный интерес к конструкциям с использованием конфигурации GameChange Solar MaxSpan EastWest™ для систем с фиксированным углом наклона. Система MaxSpanEastWest™ с фиксированным углом наклона и коэффициентом покрытия до 94%, имеющая высокопрочную стальную конструкцию и предлагаемая по конкурентоспособной цене, представляет собой достойный вариант для…
-

Опора и защита системы сельского управления – новая модель работы Чунчжоу
«Если хорошо управлять каждым уездом, то весь мир будет стабильным и единым». Управление сельскими районами является краеугольным камнем всей системы государственного управления. Городской уезд Чунчжоу в провинции Сычуань сосредоточил свое внимание на решении проблемы управления сельскими районами, а также сформировал на основе проведенного анализа рабочую систему «промышленные функциональные зоны + города и улицы + местные…
-
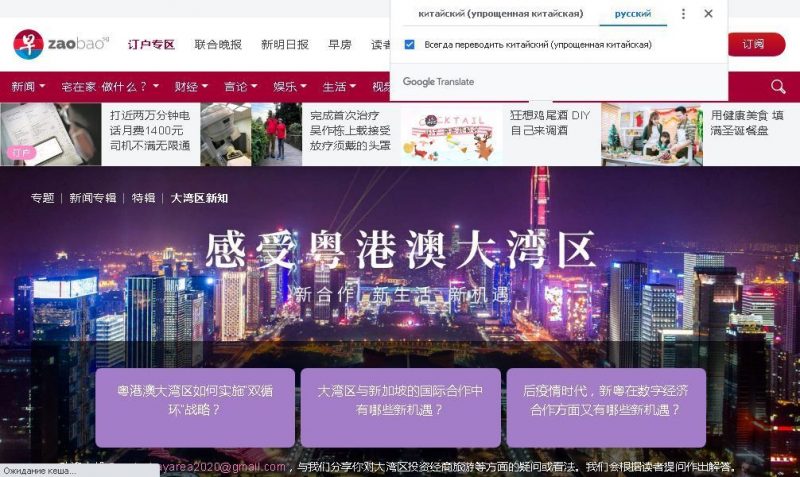
«Explore GBA» – развитие партнерства между Nanfang Media Group и CMG
16 декабря компания Nanfang Media Group и Китайская медиагруппа (Chinese Media Group, CMG) компании Singapore Press Holding s совместно разместили веб-страницу под названием «Explore GBA» («Исследуй GBA») на влиятельном новостном веб-сайте Юго-Восточной Азии zaobao.com. Две партнерские организации, одна из которых входит в число крупнейших медиагрупп в Гуандуне, а другая является крупнейшей китайской медиагруппой в Сингапуре,…
-

Honor поддержал участников всемирного семинара Red Bull Basement 2020
В сентябре текущего года HONOR — один из ведущих технологических брендов для молодежи всего мира — объединил усилия с Red Bull Basement 2020, подготовив площадку для встречи команд молодых новаторов со всего мира и побудив их к реализации технических решений и разработке приложений с целью стимулирования позитивных социальных перемен. Из 3865 студенческих команд из разных…